Kardionefrologie
Souhrn
Akutní i chronické onemocnění ledvin bývá doprovázeno postižením srdce a naopak. Porušení funkce obou orgánů má svá specifika v diagnostice i léčbě, a proto se rozvíjí nový obor zvaný kardionefrologie. V následujícím přehledu je tento obor stručně představen.
(Kap Kardiol 2020; 12: 18–21)
Klíčová slova
· srdeční selhání · chronické onemocnění ledvin · renální insuficience
Úvod
Souvislost mezi poruchou funkce ledvin a srdce je známa již dlouho. Etiopatogeneze srdečního selhání zahrnuje sníženou schopnost vylučování sodíku a vody ledvinami. Pacienti s těžším postižením ledvin sodík i vodu retinují, což vede k rozvoji edémů i dušnosti – příznaků typických pro srdeční selhání. V posledních letech je souvislostem mezi poškozením obou orgánů věnována stále větší pozornost. Hovoří se o interakci mezi těmito orgány nebo o kardionefrologii, resp. o kardiorenálních syndromech. Ve Všeobecné fakultní nemocnici v Praze vzniklo první kardionefrologické pracoviště v ČR.
Chronické onemocnění ledvin
Pro chronické onemocnění ledvin (CKD z anglického chronic kidney disease) se nejčastěji využívá definice podle KDIGO (Kidney Disease Improving Global Outcomes), která je vymezuje jako abnormality ledvinné struktury nebo funkce ledvin trvající déle než tři měsíce a mající dopad na zdraví jedince. Chronické onemocnění ledvin je charakterizováno přítomností markerů poškození ledvin nebo sníženou renální funkcí. Mezi markery poškození ledvin patří: albuminurie (> 30 mg/den, nebo poměr albuminu a kreatininu v moči = ACR z albumin/creatinine ratio > 3 mg/mmol), abnormality močového sedimentu, histologické změny, strukturní změny ledvin, tubulární postižení projevující se minerálovými abnormalitami a transplantovaná ledvina.
Chronické onemocnění ledvin se dělí podle výše glomerulární filtrace na pět stadií, která se označují G1–G5 (tab. 1). K té se přidávají stupně albuminurie A1–A3. Pacienti, u nichž selhání ledvin stupně G5 trvá alespoň tři měsíce a jsou léčeni dialyzační metodou nebo transplantací ledviny, se nacházejí v terminálním stadiu selhání ledvin (ESRD, z anglického end‑stage renal disease).
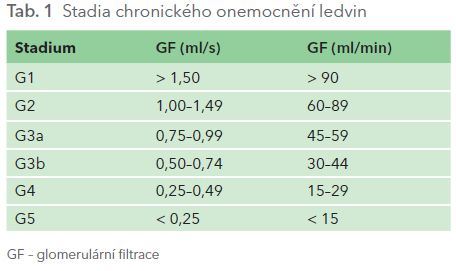
Zatímco čeští nefrologové uvádějí glomerulární filtraci v ml/s, většina zahraniční odborné literatury ji uvádí v ml/min. Často se setkáváme s tím, že za jednotkou se přidává ještě lomítko a údaj 1,73 m2, což je tělesná plocha, na kterou je výpočet kalkulován. Tělesnou plochu je třeba zohlednit zejména u zvláště velkých či malých jedinců.
Glomerulární filtraci (GF) můžeme určit jako clearance kreatininu výpočtem podle následujícího vzorce: GF = Cru·Vu/Crs, kde Cru je hladina kreatininu v moči, Vu objem moči za definovaný čas a Crs je sérová koncentrace kreatininu. Stanovení je celkem přesné, pokud pacient správně sbírá moč. V běžné klinické praxi se glomerulární filtrace počítá podle vzorců. Takto vypočítaná GF se označuje jako eGF (estimated – odhadnutá GF). V minulosti se používal výpočet podle Cockcrofta‑Gaulta, nyní se převážně doporučuje používat rovnici CKD‑EPI (CKD EPIdemiology collaboration). Tato rovnice byla zavedena do klinické praxe v roce 2009. Druhou možností je výpočet eGFR podle rovnice MDRD (Modification of Diet in Renal Disease), která se používala a stále se používá k výpočtu GF, její nevýhodou je však nepřesné určení GF u pacientů s GF nad 1 ml/s. Většina pracovišť proto přechází k rovnici CKD‑EPI. K výpočtu GF podle rovnice CKD‑EPI a MDRD je třeba použít následující parametry: sérovou koncentraci kreatininu, pohlaví, rasu, věk a ideálně i hmotnost a výšku. Výpočet lze provést např. na webové stránce www.mdrd.com. Pokud provádíme odhad GF u stabilního pacienta, můžeme výsledek snadno dosadit do tabulky 1, a zjistit tak stadium jeho chronického onemocnění ledvin.
Jednou ze základních charakteristik chronického onemocnění ledvin je snížené vylučování sodíku a vody. Zadržovaný sodík ve formě volných iontů zadržuje vodu extra‑ i intracelulárně, a navíc je elektricky a osmoticky aktivní. Lidské tělo má proto ochranný systém mukopolysacharidů, komplexních molekul, které dokážou atomy sodíku do sebe uzavřít, a vyloučit tak jeho systémové působení. Mluví se pak o neosmotickém ukládání sodíku. Uvedené mukopolysacharidy jsou lokalizovány v řadě tkání, včetně například podkoží a cévní stěny velkých tepen. Takto uložený sodík je sice tělo schopno alespoň částečně opět extrahovat, ale vzhledem k jeho neustálému přísunu se kumuluje. Je to zřejmě jeden z mechanismů vedoucích ke zvýšení tuhosti velkých tepen se všemi důsledky.
Většina pacientů s chronickým onemocněním ledvin má nějakou kardiovaskulární komplikaci, které jsou také hlavní příčinou mortality nemocných s CKD. Jejich výskyt stoupá s progresí CKD podle jednotlivých stadií uvedených v tabulce 1. Mezi nejčastější patologie patří arteriální hypertenze, akcelerace cévních postižení včetně ischemické choroby srdeční, dále pak dilatace levé srdeční síně a hypertrofie levé komory. V rozvoji těchto komplikací se uplatňuje řada mechanismů – od metabolicko‑endokrinních (např. uremické toxiny, aktivace sympatiku a osy renin‑angiotenzin‑aldosteron) po hemodynamické. Příkladem hemodynamických mechanismů je rozvoj hyperkinetické cirkulace v důsledku retence soli a tekutin. U pacientů ve stadiu G5 se uplatňuje také anémie a dialyzační arteriovenózní zkrat – oba mechanismy mají podobné důsledky jako retence tekutin. U pacientů ve stadiu G5 bývají navíc přítomny intrakardiální kalcifikace, je urychlena degenerace chlopní, popř. biologických chlopenních náhrad, častější je výskyt arytmií atd.
Srdeční selhání
Srdeční selhání je jedno z nejzávažnějších kardiovaskulárních onemocnění. Je charakterizováno nepoměrem mezi požadavky organismu na prokrvení tkání a schopností srdce dosáhnout adekvátního srdečního výdeje, popř. jen za cenu zvýšených plnících tlaků. Plnícími tlaky je myšlen krevní tlak v levé a pravé srdeční síni, resp. v komorách na konci diastoly. Zvýšený tlak v levé síni se snadno přenáší do plicních žil, což vede ke kongesci plic a dušnosti. Zvýšený tlak v pravé síni odráží zvýšení centrálního žilního tlaku – městnání v systémových žilách, jehož důsledkem může být mj. zhoršení renální funkce.
V širším slova smyslu zahrnuje pojem srdeční selhání řadu mechanismů – od systolické a diastolické dysfunkce levé komory přes chlopenní vady, některé arytmie (např. fibrilace síní s rychlou komorovou odpovědí) až po onemocnění perikardu. Všechny tyto mechanismy se u pacientů s chronickým onemocněním ledvin uplatňují ve zvýšené míře oproti stejně starým jedincům bez renálního onemocnění. V užším slova smyslu je pod termínem srdeční selhání myšleno pouze postižení levé komory. Podle aktuálních doporučení Evropské i České kardiologické společnosti je dělíme na tři fenotypy podle hodnoty ejekční frakce: srdeční selhání se sníženou ejekční frakcí levé komory – HFrEF, srdeční selhání se zachovanou ejekční frakcí levé komory – HFpEF a srdeční selhání s ejekční frakcí ve středním pásmu – HFmrEF (tab. 2). Užívané zkratky vycházejí z anglického termínu „heart failure“ a anglického výrazu „reduced“, „preserved“ a „mid‑range“. Toto dělení je do jisté míry umělé, neboť pacientovi s HFrEF stoupne například v důsledku léčby ejekční frakce, a posunul by se tak do jiné kategorie. Ponecháváme ho však v původní kategorii s dovětkem, že došlo ke zlepšení ejekční frakce/systolické funkce. Tento postup má zásadní dopad pro moderní účinnou léčbu, pro niž máme důkazy zejména v případě HFrEF, což odrážejí i úhradové podmínky zdravotních pojišťoven. Naproti tomu v případě zhoršení ejekční frakce se pacient dostává do nižší kategorie.
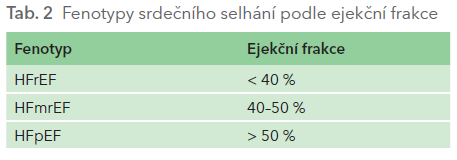
U pacientů s CKD se vyskytují všechny tři fenotypy srdečního selhání. Zdaleka nejčastějším je HFpEF, což je důsledkem hypertrofie levé komory. Ta se ve zvýšené míře nachází již v časnějších stadiích CKD a u hemodialyzovaných se objevuje až v 80 %. Navíc je známo, že hypertrofie levé komory u pacientů s CKD má odlišnou histologickou strukturu od hypertrofie v důsledku arteriální hypertenze nebo stenózy aortální chlopně. Hypertrofie levé komory vede jednak k prodloužení doby její diastolické relaxace a jednak ke snížení její poddajnosti – dvou mechanismů rozvoje diastolické dysfunkce.
Důležitý je stav pacienta, v němž je první echokardiografie, vedoucí k zařazení do příslušného fenotypu, provedena. Příkladem mohou být nemocní s fibrilací síní s rychlou komorovou odpovědí, která trvá řadu dnů nebo týdnů – u nich se rozvíjí tzv. tachykardií indukovaná kardiomyopatie, charakterizovaná difuzním poklesem kontraktility a tím i ejekční frakce levé komory. U pacientů s pokročilejší renální insuficiencí dochází k významné retenci sodíku a vody. To vede mj. k dilataci srdečních oddílů a ke zvýšení plnících tlaků levé i pravé komory. Dilatace komor vede k rozvoji sekundární mitrální a trikuspidální regurgitace. Důsledkem zvýšeného plnění komor je vzestup srdečního výdeje Frankovým‑Starlingovým mechanismem, ale po určité době se takto namáhané srdce unavuje a ejekční frakce komor začne klesat. Z těchto důvodů hraje zásadní roli čas provedení echokardiografie: je‑li provedena v akutním – dekompenzovaném – stavu, neměla by z ní být činěna závažná rozhodnutí, jako je úvaha o korekci chlopenní regurgitace, ale měla by být zopakována po oběhové kompenzaci.
Kardiorenální syndromy
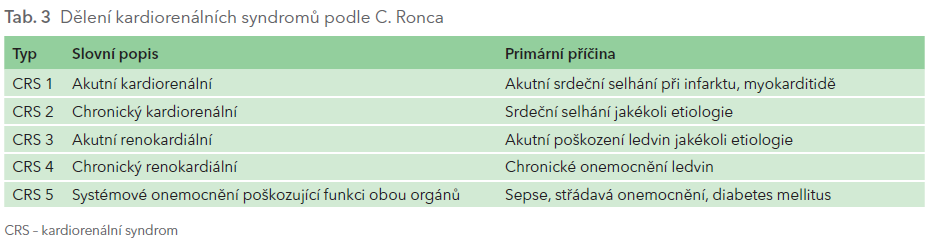
Častý výskyt postižení obou orgánů – srdce a ledvin – vedl k zavedení termínu „kardiorenální syndrom“. Vzniklo několik způsobů dělení kardiorenálních syndromů, ale nejvíce se ujalo dělení, které vymyslel italský nefrolog Claudio Ronco. Toto dělení je velmi jednoduché a současně patofyziologické – rozlišuje akutní stavy od chronických a na začátku příslušného podtypu 1–4 je název orgánu, jehož postižení stálo na začátku příslušného stavu (tab. 3). Akutní kardiorenální syndrom (typ 1) tak zahrnuje nemocné, kdy akutní onemocnění srdce (např. infarkt myokardu, myokarditida) vede k sekundárnímu postižení funkce ledvin. Chronický renokardiální syndrom (typ 4) charakterizuje například pacienta s autosomálně dominantní polycystózou ledvin, kdy CKD vede k sekundárním kardiálním komplikacím. V některých případech však nelze spolehlivě určit, které onemocnění bylo první – jako ve slavné hádance, zda byla první na světě slepice, nebo vejce. Týká se to především pacientů s chronickým postižením obou orgánů, kteří přicházejí do péče až v době, kdy je funkce obou orgánů porušena. V těchto případech se někteří experti přiklánějí k eufemistickému vyjádření typ 2/4.
Principy léčby
Pacienti s kardiorenálními syndromy jsou obvykle polymorbidní. Vedení léčby, zejména u chronických kardiorenálních syndromů, by mělo být konsensem nefrologa, kardiologa a praktického lékaře. V případě pokročilejší renální insuficience je třeba u některých léčiv redukovat dávky, jiná jsou zcela kontraindikována.
Mezi dominující stavy u chronických kardiorenálních syndromů patří arteriální hypertenze, generalizovaná ateroskleróza, diabetes mellitus, hyperurikemie, dyslipidemie atd.
Hypolipidemika: Účinné snížení koncentrace celkového a LDL cholesterolu statiny zpomaluje proces aterogeneze a má i prokazatelný nefroprotektivní vliv. Hypolipidemika jsou indikována v časnějších stadiích CKD G1–3, nejistě ve stadiu CKD G4. Protektivní význam hypolipidemik u pacientů s CKD G5 naproti tomu nebyl prokázán.
Inhibitory angiotenzin‑konvertujícího enzymu (ACE) a sartany: Tyto látky patří mezi pilíře léčby arteriální hypertenze, srdečního selhání a zároveň působí nefroprotektivně. Při jejich použití dochází u části pacientů s již přítomnou CKD k elevaci sérové koncentrace kreatininu. U takového pacienta je nutné provést kontrolní odběr s odstupem dvou týdnů. Pokud koncentrace kreatininu dále nestoupá a celkově se nezvýší o více než 30 % výchozí hladiny, doporučuje se lék ponechat, protože takové zvýšení neznamená horší renální prognózu. Je třeba také kontrolovat kalemii, a to zejména v období interkurentních infekcí, gastroenteritid apod., kdy riziko hyperkalemie významně stoupá. Obvykle začínáme inhibitory ACE a změnu medikace na sartan provádíme jen v případě intolerance inhibitorů ACE.
Thiazidová diuretika: Mají význam jen u nemocných s CKD stupně G1–3 zejména v léčbě arteriální hypertenze. Při dalším poklesu glomerulární filtrace přestávají účinkovat.
Kličková diuretika: Podáváme je k dosažení euvolemie a k redukci nepříjemných symptomů – dušnosti a otoků. V ČR jde výlučně o furosemid, který je nutné u pacientů s pokročilým CKD podávat ve vysokých dávkách. V případě těžšího oboustranného srdečního selhání je častější rezistence na furosemid – z důvodu kongesce střevní stěny, vedoucí ke snížené absorpci nejen tohoto léčiva.
Blokátory aldosteronu: Dostupný je spironolakton a eplerenon. Tyto látky jsou indikovány u pacientů se srdečním selháním typu HFrEF, u nichž zlepšují prognózu. Naopak nejsou vhodné u nemocných se sérovou koncentrací kreatininu vyšší než 220 µmol/l.
Přístrojová léčba: Do této kategorie patří hemodialýza, ultrafiltrace a peritoneální dialýza. Indikace jsou především nefrologické. V některých případech rezistence na diuretika navrhujeme tuto léčbu (zejména ultrafiltraci) i u nemocných s méně pokročilým chronickým onemocněním ledvin.
Literatura
1. Sulková S, et al. Hemodialýza. Praha: Maxdorf Jessenius 2000.
2. Viklický O, et al. Predialýza. Praha: Maxdorf Jessenius 2013.
3. Malík J, et al. Echokardiografie u pacientů s chronickým onemocněním ledvin a úvod do kardionefrologie. Praha: Maxdorf Jessenius 2018.
zpět


