Plicní embolie
Souhrn
V roce 2019 byla publikována nová Doporučení Evropské kardiologické společnosti pro diagnostiku a léčbu plicní embolie (PE). Oproti předcházejícím doporučením z roku 2014 přinesla několik významných novinek a řadu menších změn. Nejvýznamnější novinky jsou následující. V diagnostice je doporučováno používání hranic pro D‑dimer podle věku. D‑dimer má být využíván při vylučování PE i v těhotenství a po porodu. Celá riziková stratifikace PE je aktualizována. Velký důraz je kladen na hodnocení echokardiografického obrazu dysfunkce pravé komory i u nemocných se zdánlivě nízkorizikovou PE. Z ultrazvukových metod je dále pro diagnostiku i rizikovou stratifikaci doporučována kompresní ultrasonografie žil dolních končetin (CUS). V léčbě je pro praxi jistě nejzajímavější doporučení nových perorálních antikoagulancií neantagonizujících vitamin K (NOAC) jako první volby pro antikoagulační léčbu. Warfarin je pouze alternativou k NOAC. Redukovaná dávka apixabanu nebo rivaroxabanu může být navíc využita pro dlouhodobější léčbu. Edoxaban a rivaroxaban mohou být s opatrností využity i u nemocných s nádorovým onemocněním mimo gastrointestinální trakt. Při hemodynamické nestabilitě je větší důraz kladen na trombolytickou léčbu, eventuálně na chirurgickou nebo katetrizační embolektomii. Využita může být i extrakorporální mimotělní oxygenace (ECMO). Byly vytvořeny nové algoritmy pro sledování a péči o nemocné po PE, nejen s podezřením na chronickou tromboembolickou plicní hypertenzi (CTEPH). V textu sdělení jsou rozvedeny především vyjmenované novinky. Zvláštní pozornost je věnována mimonemocniční části péče. (Kap Kardiol 2020; 12: 44–47)
Klíčová slova
· akutní plicní embolie · mimonemocniční péče · doporučení 2019
Problematika plicní embolie je jistě velmi důležitá. Výskyt PE narůstá, mortalita přesto klesá. K většímu výskytu PE přispívá zřejmě mimo jiné lepší diagnostika. K dalšímu snižování mortality a následků PE mají přispět i novinky a aktualizace v doporučeních pro diagnostiku a léčbu. S ohledem na limitovaný rozsah článku nejsou uvedena celá doporučení, ale je poskytnut především přehled změn a novinek. Zvláštní pozornost je věnována mimonemocniční péči.
Diagnostika
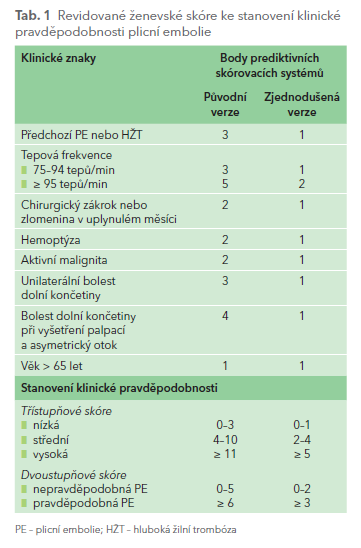
Pro stanovení klinické pravděpodobnosti, respektive nepravděpodobnosti PE je doporučeno revidované ženevské skóre (tab. 1) a Wellsovo skóre. Pokud jsou tato skóre nízká a proti PE současně svědčí tzv. kritéria PERC (pulmonary embolism rule‑out criteria), lze považovat PE za vyloučenou bez dalšího vyšetřování. Kritéria PERC zahrnují: věk < 50 let, puls < 100/min, saturace hemoglobinu kyslíkem (SaO2) > 94 %, nepřítomnost asymetrického otoku dolní končetiny, hemoptýzy, traumatu či chirurgického zákroku, absence předchozí tromboembolické komplikace či užívání perorální hormonální antikoncepce.
Pro vyloučení PE se využívá vyšetřování D‑dimerů. Za hranici pro vyloučení PE je běžně považována hodnota 500 μg/ml. U vyšetřovaných bez klinických příznaků (příznaků žilní trombózy, hemoptýzy a pravděpodobnější přítomnosti PE než alternativní diagnózy) je tato hranice dokonce 1 000 μg/ml. Diagnostická hranice D‑dimerů adjustovaná u osob starších 50 let na věk (věk × 10 μg/l) zlepšuje diagnostický přínos testu.
Vyšetření D‑dimerů v těhotenství nebo po porodu má být pro účel vyloučení PE kombinováno se stanovením klinické pravděpodobnosti. Koncentrace D‑dimerů v průběhu gravidity roste. Čtvrtina žen ve třetím trimestru přesahuje hraniční hodnotu pro vyloučení PE v běžné populaci.
Je‑li to možné, doporučuje se k vyloučení PE provádění „point‑of‑care“ testování D‑dimerů v ambulantních praxích včetně primární péče místo odesílání do komplexního zdravotnického zařízení. Je to v zájmu urychlení diagnostického procesu.
Echokardiografické vyšetření není nutnou součástí diagnostického postupu u hemodynamicky stabilních pacientů, ale je přínosné při diferenciální diagnostice akutní dušnosti. Přítomnost dilatace pravé komory (PK) je významným ukazatelem rizikovosti onemocnění. U pacientů s podezřením na vysoce rizikovou PE nepřítomnost echokardiografických známek přetížení nebo dysfunkce PK prakticky vylučuje PE jako příčinu hemodynamické nestability. Diagnózu PE velmi podporuje kombinace akceleračního času systolického toku v plicnici < 60 ms s hodnotou vrcholového systolického gradientu na trikuspidální chlopni < 60 mm Hg nebo snížená kontraktilita volné stěny PK v porovnání s hrotem PK (McConnellovo znamení) Může být také snížená amplituda systolické exkurze trikuspidálního anulu (TAPSE). Snížení může být patrné i při tkáňovém dopplerovském vyšetření (TDI) PK včetně strainu volné stěny.
Kompresní žilní ultrasonografie (CUS) dolních končetin je doporučována pro potvrzení podezření na PE před provedením CT plicní angiografie (CTPA) nebo při její neproveditelnosti. Následně musí být CUS stejně provedena k objasnění zdroje PE, jelikož je flebotrombóza dolní končetiny příčinou PE v 70 %. U nemocného s klinickým podezřením na PE a průkazem proximální hluboké žilní trombózy (HŽT) podle CUS je PE považována za potvrzenou. Pokud CUS ukazuje na distální HŽT, měla by být pro potvrzení diagnózy provedena další vyšetření.
Riziková stratifikace
Riziková stratifikace je v podstatě součástí diagnostiky. Riziko je dáno především hemodynamickou nestabilitou. Nejvážnějším časným projevem hemodynamické závažnosti PE je oběhová zástava. Závažným projevem je obstrukční šok. Velmi rizikový je ale i stav se systolickým tlakem (sTK) < 90 mm Hg nebo poklesem sTK ≥ 40 mm Hg trvajícím 15 a více minut, není‑li možnou vyvolávající příčinou arytmie, hypovolemie nebo sepse. Tato klasifikace není novinkou, ale samotný pokles TK je podceňovaným a opomíjeným příznakem, a proto je zde připomenut.
Indexy závažnosti plicní embolie (Pulmonary Embolism Severity Index, PESI a Simplified Pulmonary Embolism Severity Index, sPESI) také nejsou novinkou (tab. 2). Jejich stanovení je ale zásadní při rozhodování o možnosti ambulantní léčby PE, která je doporučována pro stále větší procento nemocných s PE s nízkým a velmi nízkým rizikem.
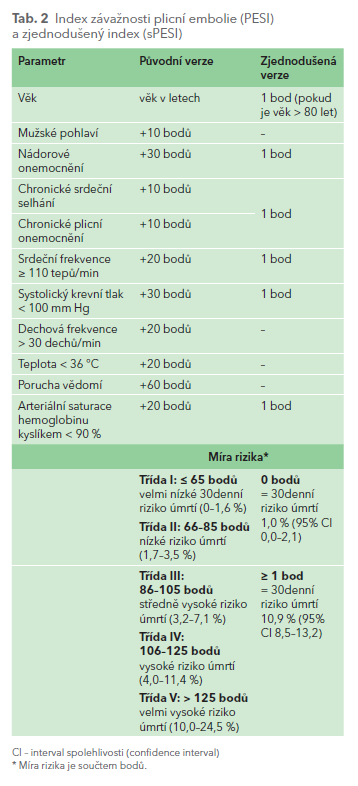
Význam echokardiografie pro rizikovou stratifikaci je dobře znám.
Z laboratorních parametrů je důležité stanovení srdečních troponinů. Koncentrace srdečního troponinu T < 14 ng/l při použití vysoce senzitivní metody má 98% negativní prediktivní hodnotu pro nepřítomnost nežádoucí klinické příhody související s PE během hospitalizace. Pro osoby ve věku ≥ 75 let je takovou hranicí 45 ng/l. Pro stanovení troponinů I s možností použití kitů různých firem nejsou hodnoty tak validovány. Vyšší koncentrace troponinů znamenají větší riziko komplikací.
Vysokou negativní prediktivní hodnotu pro komplikace PE mají také natriuretické peptidy. Konkrétně při selekci pacientů vhodných pro domácí léčbu je doporučena hodnota NT‑proBNP < 500 ng/l.
Léčba
Základem terapie je antikoagulační léčba. Podle studií nastupuje účinek NOAC při zahájení léčby stejně rychle jako podkožní podání nízkomolekulárních heparinů (LMWH) a je bezpečnější, jsou‑li splněny ostatní podmínky pro jejich podání. První volbou jsou NOAC i v navazující antikoagulační léčbě. Léčba edoxabanem a rivaroxabanem je alternativou k LMWH i u nemocných s nádorovým onemocněním kromě pacientů s nádorem gastrointestinálního traktu. Apixabanem a rivaroxabanem lze léčbu při PE zahajovat bez předléčení heparinem. Léčbě dabigatranem a edoxabanem by mělo předcházet alespoň pětidenní podávání LMWH. Dlouhodobá léčba warfarinem zůstává lékem volby u nemocných s antifosfolipidovým syndromem. Výhodou NOAC oproti warfarinu je kromě pohodlnější léčby bez režimových opatření menší výskyt krvácení především při dlouhodobém podávání. Kontraindikovány jsou NOAC v těhotenství a laktaci, omezeny jsou při závažnější renální insuficienci.
Nízkomolekulární hepariny jsou základem léčby i při dlouhodobé potřebě podávání u pacientů s nádory gastrointestinálního traktu, s poruchami polykání a absorpce, v těhotenství a laktaci a v případě významné renální insuficience.
Antikoagulace nefrakcionovaným heparinem bolusově i.v. v dávce 80 j./kg má být zahájena ihned při podezření na vysoce rizikovou PE. Na tuto tradiční léčbu jako by se v éře nízkomolekulárních heparinů trochu zapomínalo. Pokud není k dispozici nefrakcionovaný heparin, je při nejasném stavu menší chybou podání LMWH i.v. než podkožně. Efekt i.v. aplikace lze na rozdíl od s.c. aplikace ukončit.
Záchrannou léčbou při šokovém stavu nebo oběhové zástavě je trombolytická léčba, katetrizační odsátí nebo fragmentace embolu nebo chirurgická embolektomie. Není dostatek studií srovnávajících mechanickou trombektomii se systémovou trombolýzou. Podle zkušeností z poslední doby může být přínosné také použití extrakorporální membránové oxygenace (ECMO), eventuálně v kombinaci s chirurgickou nebo katetrizační léčbou. I u těhotných je při těžkém stavu léčbou volby trombolýza nebo chirurgická embolektomie.
Pokud dojde na potřebu kardiopulmonální resuscitace, je vhodnou pomůckou pro rozhodnutí o podání trombolytické léčby během zástavy echokardiografie. Výrazně dilatovaná PK může usnadnit rozhodnutí o potenciálně nebezpečné léčbě. Je to jedna z indikací malého echokardiografického přístroje ve vozech záchranné služby.
Optimální čas přechodu z eventuální parenterální léčby u nemocných s vysoce rizikovou PE na perorální antikoagulaci je otázkou klinického úsudku. Nejsou k dispozici žádná data dávající nějaké vodítko.
Většina nemocných s PE má relativně lehký průběh bez dalších komplikací. Až 50 % nemocných může být hospitalizováno jen krátce nebo mohou být léčeni od začátku doma. Vhodnými kandidáty domácí léčby jsou nemocní: a) s nízkým rizikem časného úmrtí nebo vážných komplikací souvisejících s PE; b) s nepřítomností závažných komorbidit nebo stavů vyžadujících hospitalizaci; c) s možností zajištění ambulantní antikoagulační léčby i s přihlédnutím k sociálnímu zázemí a compliance k léčbě (obr. 1).
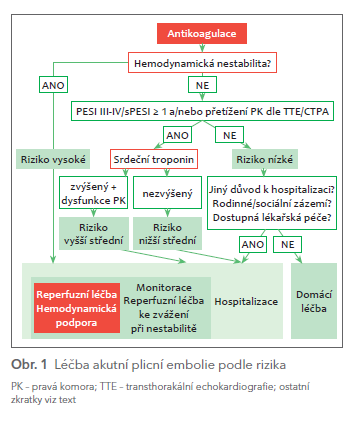
Pro nízké riziko svědčí PESI ≤ II, respektive sPESI = 0 a nepřítomnost vylučovacích kritérií ze studie Hestia (tab. 3). Při plánování časné dimise po 24–48 hodinách hospitalizace je vhodné zohlednit i výsledky biochemických vyšetření a především echokardiografie s vyloučením dysfunkce PK a trombů v pravostranných srdečních oddílech.

Pro péči o nemocné s PE s vysokým rizikem jsou doporučeny multidisciplinární týmy zahrnující odborníky z kardiologie, pneumologie, hematologie, angiologie, anesteziologie a intenzivní medicíny, kardiochirurgie a intervenční radiologie.
Prevence rekurence tromboembolické nemoci
U všech pacientů s PE je minimální doba antikoagulační léčby tři měsíce. Prodloužení léčby výrazně snižuje rekurenci za cenu nárůstu krvácení.
Rizikovými faktory krvácení jsou: věk > 75 let, předchozí krvácení nebo anémie, aktivní nádorové onemocnění, předchozí hemoragická nebo ischemická cévní mozková příhoda, chronická insuficience ledvin nebo jater, souběžné užívání antiagregancií nebo nesteroidních antiflogistik, jakýkoli jiný závažný akutní nebo chronický stav a špatná kontrola antikoagulační léčby.
Trvalá antikoagulační léčba má být zvážena u pacientů s první epizodou PE bez reverzibilního vyvolávajícího rizikového faktoru, s některou z forem dědičné trombofilie (deficit antitrombinu, proteinu C nebo S, homozygotní mutace faktoru V Leiden nebo genu pro protrombin G20210A).
Pokud je rozhodnuto o prodloužené antikoagulaci pomocí NOAC u pacienta bez nádorového onemocnění, měla by být po šestiměsíční terapeutické antikoagulaci zvážena redukovaná dávka apixabanu (2,5 mg 2× denně) nebo rivaroxabanu (10 mg 1× denně).
Vyšetření trombofilních stavů je doporučeno především u mladších pacientů bez zřejmého vyvolávajícího faktoru.
Onkologický screening okultního nádorového onemocnění jakožto možné vyvolávající příčiny tromboembolické choroby je doporučeno omezit na anamnézu, fyzikální vyšetření, základní laboratorní vyšetření a snímek hrudníku (pokud nebyla provedena CTPA). Přesto je podle autora článku vhodné, pokud jsou zanedbávána preventivní vyšetření, minimálně vyšetření prostaty či gynekologické vyšetření.
Literatura
1. Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society: The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology. Eur Heart J 2020;4:543–603.
2. Rokyta R, Hutyra M, Jansa P. Doporučené postupy Evropské kardiologické společnosti pro diagnostiku a léčbu akutní plicní embolie, verze 2019. Stručný přehled vypracovaný Českou kardiologickou společností. Cor Vasa 2020;62:154–182.
3. Malý R, Veleta T, Čermáková M. Možnosti ambulantní léčby plicní embolie. Akut Kardiol 2019;18:102–104.
zpět


